«Prion» est un terme employé pour décrire le mystérieux agent infectieux responsable de plusieurs maladies neurodégénératives qui se manifestent chez des mammifères. Le mot vient de « particule protéique infectieuse », terme utilisé en 1982 par Stanley B. Prusiner (prix Nobel de médecine en 1997) pour se référer à l’agent infectieux qui provoquait la tremblante (scrapie) chez les moutons, le Kuru et la maladie de Creutzfeldt-Jakob (MCJ) chez les hommes, ainsi que l’encéphalopathie spongiforme bovine (ESB) chez les bovins. Les maladies à prions ont toujours existé mais leur incidence sur la population est, en général, extrêmement faible.
Dans les années 80, les vaches qui avaient consommé des aliments contaminés par des cadavres de moutons touchés par la tremblante, développèrent l’ESB. Au milieu des années 90, des personnes qui avaient mangé de la viande de vaches malades manifestèrent une variante de la maladie de Creutzfeldt-Jakob, recevant le nom de « maladie de la vache folle ».
L’agent infectieux est une protéine qui se trouve dans les membranes de cellules normales (PrPc), principalement du système nerveux central. Dans ces maladies, la protéine prend une conformation anormale (PrPSc) qui se lie à d’autres protéines voisines, induisant une modification de la configuration qui provoque une réaction en chaîne et favorise la production de nouvelles protéines infectieuses. Manger de la viande de vaches malades peut provoquer que la protéine prion normale se replie de façon atypique, donnant lieu à l’isoforme altérée. On pense également que la maladie a été transmise à des patients qui avaient reçu des greffes de cornée et de dure-mère de donneurs malades, par la protéine anormale. De même, des cas exceptionnels de transmission par voie iatrogène ont été recensés, à travers l’utilisation de dispositifs médicaux contaminés par des résidus organiques de personnes affectées, mais qui n’ont représenté ni 1 % des cas recensés depuis 19501. Les périodes d’incubation de ces maladies sont très longues et les symptômes sont très variés dans le temps, conduisant à une détérioration neurodégénérative extrême au cours des derniers stades de la maladie qui se termine par le décès du patient.
La PrPsc est très résistante aux méthodes de désinfection et de stérilisation conventionnelles et sa résistance peut être renforcée par l’utilisation d’agents de fixation si les protéines n’ont pas été éliminées de façon efficace au cours des premières étapes de retraitement.
Certains pays ont mis en place des réglementations spécifiques visant à garantir l’élimination/inactivation des protéines prions des dispositifs médicaux. Elles se basent toutes sur la détection de patients à risque (confirmés, avec symptômes ou contraintes génétiques) et l’attention particulière des chirurgies liées au système nerveux central (tissus à haut risque) : cerveau, moelle épinière ou partie postérieure de l’œil. Voici quelques exemples de base :
- Utiliser, chaque fois que cela est possible, des dispositifs sanitaires à usage unique.
- Si cela n’est pas possible, le dispositif médical doit être mis en quarantaine jusqu’à confirmation de l’absence de risque, ou être détruit dans le cas d’une contamination.
- Utilisation de procédés ayant, expérimentalement, démontré leur capacité à inactiver le prion, en détruisant la protéine.
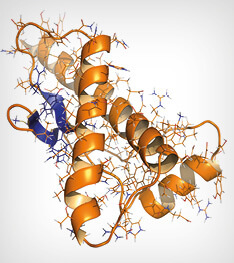
Protéine prion humaine (hPrP), structure chimique. Associée à des maladies neurogènes, notamment le kuru, l’ESB et le Creutzfeldt-Jakob. Illustration animée Cartoon & Wireframe. Coloration de la structure secondaire (feuilles bleues, hélices oranges).
L’évaluation de l’inactivation du prion s’appuie sur des expériences compliquées in vivo. L’utilisation d’hypochlorite de sodium à des ppm donnés, l’hydroxyde de sodium, les détergents alcalins au pH élevé, certains cycles de stérilisation à basse température et l’utilisation combinée de ces détergents alcalins avec des cycles à basse température, ont fait ressortir leur efficacité. Celle-ci doit être démontrée dans des conditions parfaitement définies : concentration, température, temps d’exposition, etc. et ne sont valables que dans ces circonstances. Les cycles de vapeur à 134 °C / 18 minutes sont d’une grande efficacité bien que l’inactivation puisse être incomplète. Il est donc recommandé de procéder à un nettoyage alcalin préalable pour les instruments utilisés sur des tissus à risques.
Certaines méthodes de stérilisation, nettoyage et désinfection peuvent favoriser la fixation protéique sur les surfaces des instruments chirurgicaux : alcool, glutaraldéhyde, chaleur sèche, oxyde d’éthylène ou d’autres agents stérilisants de type aldéhydique. Les pays ayant adopté une réglementation sur les prions particulière peuvent déconseiller l’utilisation de ces méthodes ou exiger un procédé préalable, non fixateur, avant d’appliquer ces technologies, comme par exemple l’utilisation de détergents alcalins au pH élevé, le fabricant déclarant leur capacité inactivante.
Enfin, certains pays peuvent fixer leurs propres réglementations quant aux méthodes et seuils de détection des résidus de protéine sur les dispositifs médicaux, en appliquant des niveaux et des précautions supplémentaires pour les instruments utilisés sur des tissus à haut risque. Par exemple, les recommandations du HTM 0101 britannique de 2017 établissent des niveaux inférieurs à 5 µg de résidus protéiques pour le matériel à risque et inférieur à 8 µg pour le reste. La mise en œuvre de méthodes de détection protéique peut être très utile dans le cas des RUMED afin d’établir une évaluation du risque.
1 Human prion diseases: surgical lessons learned from iatrogenic prion transmission. David J. Bonda et col. Neurosurgical Focus. 2016 Jul; 41(1): E10.
Autres sources utilisées :
- Guías de la WFHSS 2019: https://wfhss-guidelines.com/reusable-medical-device/
- Reducing the risk of transmission of Creutzfeldt–Jakob disease (CJD) from surgical instruments used for interventional procedures on high-risk tissues Interventional procedures guidance [IPG666]Published date: January 2020. NICE: National Institute for Health and Care Excellence
- Health Technical Memorandum (HTM) 01-01 on the management and decontamination of surgical instruments (medical devices) used in acute care. March 2013: Hygiene requirements for the reprocessing of medical devices. Recommendation of the KRINKI at the RKI and NfArM Bundesgesundheitsbl 2012 · 55:1244-1310.
- World Health Organization. Infection control guidelines for transmissible spongiform encephalopathies. Report of a WHO Consultation, Ginebra, Suiza, 23-26 Marzo, 1999. (http://www.who.com)

Derniers Commentaires